公司新聞
香港,2019年12月12日
億勝生物科技有限公司(“億勝生物”或“集團”—股份代碼:1061)欣然公佈,由億勝生物投資(集團全資附屬子公司)資助開展的用於治療中度至重度乾眼症的SkQ1化合物在美國FDA三期臨床第二階段試驗取得關鍵進展。
億勝生物與MitotechS.A.(“Mitotech”)正式啟動一項SkQ1用於乾眼症患者的三期臨床研究,旨在確認今年早些時候美國三期臨床第一階段試驗(VISTA-1)中獲得的SkQ1滴眼液快速改善乾眼症症狀和體征的臨床結果。
基於SkQ1化合物在VISTA-1(一項在美國開展的2b/3期臨床試驗)中表現的積極結果,億勝生物與Mitotech共同宣佈了首批病人入組美國三期臨床第二階段試驗(VISTA-2)。SkQ1是一種靶向線粒體心磷脂過氧化的抑制劑,用於開發治療包括乾眼症在內的一系列年齡相關性疾病的藥物。億勝生物已同意為三期臨床第二階段試驗提供不高於20,000,000美元(約合156,600,000港元)的資金。
Mitotech首席執行官Natalia Perekhvatova表示:“VISTA-1的研究數據傳遞出一個明確資訊,這在幹眼臨床研究中是罕見的:VISTA-1結果顯示SkQ1能够快速改善一系列幹眼臨床相關症狀和體征(如眼部不適和熒光素染色),並擁有與人工淚液媲美的藥物耐受性。SkQ1已成為全球乾眼症患者重要的潜在治療方案。”
VISTA-1是一項隨機、雙盲、安慰劑對照的多中心臨床試驗,其中包括三個治療組,分別給予兩種不同劑量的SkQ1滴眼液及安慰劑。該試驗在美國的多個實驗中心招募約450名病人,他們接受每天兩次用藥共兩個月的療程。該研究雖然未達到主要聯合臨床終點(中央角膜螢光素染色和砂礫感),但仍達到多個預設次要終點,顯示了SkQ1在意向治療(ITT)人群中的廣泛治療效果。相對於安慰劑組(人工淚液),意向治療(ITT)人群給予SkQ1滴眼液短短4周後眼部不適症狀顯著減輕(p<0.05),並且4種症狀量表中的多項症狀也有顯著減輕(p<0.05)。此外,相對於安慰劑組,意向治療(ITT)人群結膜螢光素染色(一項全球公認的臨床體征)也顯著降低(p<0.05)。同時,臨床研究結果也凸顯了藥物優秀的安全性,表現在其耐受性在統計學意義上與人工淚液相似。
億勝生物投資總裁嚴賢龍表示:“VISTA-1的積極結果讓我們備受鼓舞,並促使我們决定繼續投資推進VISTA-2,我們很高興能够繼續與MitotechS.A.合作,在將SkQ1推向全球乾眼症市場的行程中又邁進了一步。”VISTA-2是一項隨機、雙盲、安慰劑對照的多中心臨床試驗,試驗設計與VISTA-1類似,但僅包括兩個治療組(SkQ1與安慰劑),且每個治療組招募患者人數(300人)是VISTA-1的兩倍。現時預計VISTA-2將於2020年第二季度或前後完成。
有關VISTA-2臨床試驗的更多資訊,後續可通過www.clinicaltrials.gov查閱。
關於SkQ1
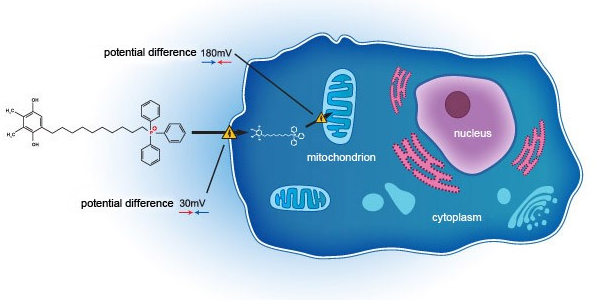
SkQ1通過一種創新的機制在細胞水准上作用於線粒體,達到治療乾眼症的目的。不同於與現行多數採用抗炎機制的治療手段,SkQ1通過靶向阻斷眼部氧化應激反應,不僅減輕眼部炎症反應,也可以改善眼錶組織退化、淚液質量下降等問題。VISTA-1——一項在美國開展的2b/3期臨床試驗(NCT03764735)顯示,SkQ1能有效改善乾眼症受試者的眼部症狀及體征。
關於MitotechS.A.
MitotechS.A.是一家總部位於盧森堡的臨床階段生物技術公司,主要開發治療老齡化相關性疾病創新藥物。Mitotech的產品核心技術基於一類新型小分子——靶向線粒體心磷脂過氧化的抑制劑。公司先導化合物SkQ1現時正處於一系列藥物劑型的開發中,覆蓋多個疾病治療領域,其中以眼科和神經退行性疾病為主。
億勝生物科技有限公司(“億勝生物”或“集團”—股份代碼:1061)欣然公佈,由億勝生物投資(集團全資附屬子公司)資助開展的用於治療中度至重度乾眼症的SkQ1化合物在美國FDA三期臨床第二階段試驗取得關鍵進展。
億勝生物與MitotechS.A.(“Mitotech”)正式啟動一項SkQ1用於乾眼症患者的三期臨床研究,旨在確認今年早些時候美國三期臨床第一階段試驗(VISTA-1)中獲得的SkQ1滴眼液快速改善乾眼症症狀和體征的臨床結果。
基於SkQ1化合物在VISTA-1(一項在美國開展的2b/3期臨床試驗)中表現的積極結果,億勝生物與Mitotech共同宣佈了首批病人入組美國三期臨床第二階段試驗(VISTA-2)。SkQ1是一種靶向線粒體心磷脂過氧化的抑制劑,用於開發治療包括乾眼症在內的一系列年齡相關性疾病的藥物。億勝生物已同意為三期臨床第二階段試驗提供不高於20,000,000美元(約合156,600,000港元)的資金。
Mitotech首席執行官Natalia Perekhvatova表示:“VISTA-1的研究數據傳遞出一個明確資訊,這在幹眼臨床研究中是罕見的:VISTA-1結果顯示SkQ1能够快速改善一系列幹眼臨床相關症狀和體征(如眼部不適和熒光素染色),並擁有與人工淚液媲美的藥物耐受性。SkQ1已成為全球乾眼症患者重要的潜在治療方案。”
VISTA-1是一項隨機、雙盲、安慰劑對照的多中心臨床試驗,其中包括三個治療組,分別給予兩種不同劑量的SkQ1滴眼液及安慰劑。該試驗在美國的多個實驗中心招募約450名病人,他們接受每天兩次用藥共兩個月的療程。該研究雖然未達到主要聯合臨床終點(中央角膜螢光素染色和砂礫感),但仍達到多個預設次要終點,顯示了SkQ1在意向治療(ITT)人群中的廣泛治療效果。相對於安慰劑組(人工淚液),意向治療(ITT)人群給予SkQ1滴眼液短短4周後眼部不適症狀顯著減輕(p<0.05),並且4種症狀量表中的多項症狀也有顯著減輕(p<0.05)。此外,相對於安慰劑組,意向治療(ITT)人群結膜螢光素染色(一項全球公認的臨床體征)也顯著降低(p<0.05)。同時,臨床研究結果也凸顯了藥物優秀的安全性,表現在其耐受性在統計學意義上與人工淚液相似。
億勝生物投資總裁嚴賢龍表示:“VISTA-1的積極結果讓我們備受鼓舞,並促使我們决定繼續投資推進VISTA-2,我們很高興能够繼續與MitotechS.A.合作,在將SkQ1推向全球乾眼症市場的行程中又邁進了一步。”VISTA-2是一項隨機、雙盲、安慰劑對照的多中心臨床試驗,試驗設計與VISTA-1類似,但僅包括兩個治療組(SkQ1與安慰劑),且每個治療組招募患者人數(300人)是VISTA-1的兩倍。現時預計VISTA-2將於2020年第二季度或前後完成。
有關VISTA-2臨床試驗的更多資訊,後續可通過www.clinicaltrials.gov查閱。
關於SkQ1
SkQ1通過一種創新的機制在細胞水准上作用於線粒體,達到治療乾眼症的目的。不同於與現行多數採用抗炎機制的治療手段,SkQ1通過靶向阻斷眼部氧化應激反應,不僅減輕眼部炎症反應,也可以改善眼錶組織退化、淚液質量下降等問題。VISTA-1——一項在美國開展的2b/3期臨床試驗(NCT03764735)顯示,SkQ1能有效改善乾眼症受試者的眼部症狀及體征。
關於MitotechS.A.
MitotechS.A.是一家總部位於盧森堡的臨床階段生物技術公司,主要開發治療老齡化相關性疾病創新藥物。Mitotech的產品核心技術基於一類新型小分子——靶向線粒體心磷脂過氧化的抑制劑。公司先導化合物SkQ1現時正處於一系列藥物劑型的開發中,覆蓋多個疾病治療領域,其中以眼科和神經退行性疾病為主。
相關新聞




























































 粤公网安备 44049102496184号
粤公网安备 44049102496184号