公司新闻
香港,2019年12月12日
亿胜生物科技有限公司(“亿胜生物”或“集团”—股份代码:1061)欣然公布,由亿胜生物投资(集团全资附属子公司)资助开展的用于治疗中度至重度干眼症的SkQ1化合物在美国FDA三期临床第二阶段试验取得关键进展。
亿胜生物与MitotechS.A.(“Mitotech”)正式启动一项SkQ1用于干眼症患者的三期临床研究,旨在确认今年早些时候美国三期临床第一阶段试验(VISTA-1)中获得的SkQ1滴眼液快速改善干眼症症状和体征的临床结果。
基于SkQ1化合物在VISTA-1(一项在美国开展的2b/3期临床试验)中表现的积极结果,亿胜生物与Mitotech共同宣布了首批病人入组美国三期临床第二阶段试验(VISTA-2)。SkQ1是一种靶向线粒体心磷脂过氧化的抑制剂,用于开发治疗包括干眼症在内的一系列年龄相关性疾病的药物。亿胜生物已同意为三期临床第二阶段试验提供不高于20,000,000美元(约合156,600,000港元)的资金。
Mitotech首席执行官Natalia Perekhvatova表示:“VISTA-1的研究数据传递出一个明确信息,这在干眼临床研究中是罕见的:VISTA-1结果显示SkQ1能够快速改善一系列干眼临床相关症状和体征(如眼部不适和荧光素染色),并拥有与人工泪液媲美的药物耐受性。SkQ1已成为全球干眼症患者重要的潜在治疗方案。”
VISTA-1是一项随机、双盲、安慰剂对照的多中心临床试验,其中包括三个治疗组,分别给予两种不同剂量的SkQ1滴眼液及安慰剂。该试验在美国的多个实验中心招募约450名病人,他们接受每天两次用药共两个月的疗程。该研究虽然未达到主要联合临床终点(中央角膜荧光素染色和砂砾感),但仍达到多个预设次要终点,显示了SkQ1在意向治疗(ITT)人群中的广泛治疗效果。相对于安慰剂组(人工泪液),意向治疗(ITT)人群给予SkQ1滴眼液短短4周后眼部不适症状显著减轻(p<0.05),并且4种症状量表中的多项症状也有显著减轻(p<0.05)。此外,相对于安慰剂组,意向治疗(ITT)人群结膜荧光素染色(一项全球公认的临床体征)也显著降低(p<0.05)。同时,临床研究结果也凸显了药物优秀的安全性,表现在其耐受性在统计学意义上与人工泪液相似。
亿胜生物投资总裁严贤龙表示:“VISTA-1的积极结果让我们备受鼓舞,并促使我们决定继续投资推进VISTA-2,我们很高兴能够继续与MitotechS.A.合作,在将SkQ1推向全球干眼症市场的进程中又迈进了一步。”VISTA-2是一项随机、双盲、安慰剂对照的多中心临床试验,试验设计与VISTA-1类似,但仅包括两个治疗组(SkQ1与安慰剂),且每个治疗组招募患者人数(300人)是VISTA-1的两倍。目前预计VISTA-2将于2020年第二季度或前后完成。
有关VISTA-2临床试验的更多信息,后续可通过www.clinicaltrials.gov查阅。
关于SkQ1
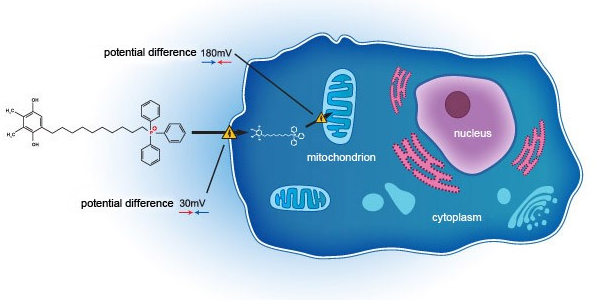
SkQ1通过一种创新的机制在细胞水平上作用于线粒体,达到治疗干眼症的目的。不同于与现行多数采用抗炎机制的治疗手段,SkQ1通过靶向阻断眼部氧化应激反应,不仅减轻眼部炎症反应,也可以改善眼表组织退化、泪液质量下降等问题。VISTA-1——一项在美国开展的2b/3期临床试验(NCT03764735)显示,SkQ1能有效改善干眼症受试者的眼部症状及体征。
关于MitotechS.A.
MitotechS.A.是一家总部位于卢森堡的临床阶段生物技术公司,主要开发治疗老龄化相关性疾病创新药物。Mitotech的产品核心技术基于一类新型小分子——靶向线粒体心磷脂过氧化的抑制剂。公司先导化合物SkQ1目前正处于一系列药物剂型的开发中,覆盖多个疾病治疗领域,其中以眼科和神经退行性疾病为主。
亿胜生物科技有限公司(“亿胜生物”或“集团”—股份代码:1061)欣然公布,由亿胜生物投资(集团全资附属子公司)资助开展的用于治疗中度至重度干眼症的SkQ1化合物在美国FDA三期临床第二阶段试验取得关键进展。
亿胜生物与MitotechS.A.(“Mitotech”)正式启动一项SkQ1用于干眼症患者的三期临床研究,旨在确认今年早些时候美国三期临床第一阶段试验(VISTA-1)中获得的SkQ1滴眼液快速改善干眼症症状和体征的临床结果。
基于SkQ1化合物在VISTA-1(一项在美国开展的2b/3期临床试验)中表现的积极结果,亿胜生物与Mitotech共同宣布了首批病人入组美国三期临床第二阶段试验(VISTA-2)。SkQ1是一种靶向线粒体心磷脂过氧化的抑制剂,用于开发治疗包括干眼症在内的一系列年龄相关性疾病的药物。亿胜生物已同意为三期临床第二阶段试验提供不高于20,000,000美元(约合156,600,000港元)的资金。
Mitotech首席执行官Natalia Perekhvatova表示:“VISTA-1的研究数据传递出一个明确信息,这在干眼临床研究中是罕见的:VISTA-1结果显示SkQ1能够快速改善一系列干眼临床相关症状和体征(如眼部不适和荧光素染色),并拥有与人工泪液媲美的药物耐受性。SkQ1已成为全球干眼症患者重要的潜在治疗方案。”
VISTA-1是一项随机、双盲、安慰剂对照的多中心临床试验,其中包括三个治疗组,分别给予两种不同剂量的SkQ1滴眼液及安慰剂。该试验在美国的多个实验中心招募约450名病人,他们接受每天两次用药共两个月的疗程。该研究虽然未达到主要联合临床终点(中央角膜荧光素染色和砂砾感),但仍达到多个预设次要终点,显示了SkQ1在意向治疗(ITT)人群中的广泛治疗效果。相对于安慰剂组(人工泪液),意向治疗(ITT)人群给予SkQ1滴眼液短短4周后眼部不适症状显著减轻(p<0.05),并且4种症状量表中的多项症状也有显著减轻(p<0.05)。此外,相对于安慰剂组,意向治疗(ITT)人群结膜荧光素染色(一项全球公认的临床体征)也显著降低(p<0.05)。同时,临床研究结果也凸显了药物优秀的安全性,表现在其耐受性在统计学意义上与人工泪液相似。
亿胜生物投资总裁严贤龙表示:“VISTA-1的积极结果让我们备受鼓舞,并促使我们决定继续投资推进VISTA-2,我们很高兴能够继续与MitotechS.A.合作,在将SkQ1推向全球干眼症市场的进程中又迈进了一步。”VISTA-2是一项随机、双盲、安慰剂对照的多中心临床试验,试验设计与VISTA-1类似,但仅包括两个治疗组(SkQ1与安慰剂),且每个治疗组招募患者人数(300人)是VISTA-1的两倍。目前预计VISTA-2将于2020年第二季度或前后完成。
有关VISTA-2临床试验的更多信息,后续可通过www.clinicaltrials.gov查阅。
关于SkQ1
SkQ1通过一种创新的机制在细胞水平上作用于线粒体,达到治疗干眼症的目的。不同于与现行多数采用抗炎机制的治疗手段,SkQ1通过靶向阻断眼部氧化应激反应,不仅减轻眼部炎症反应,也可以改善眼表组织退化、泪液质量下降等问题。VISTA-1——一项在美国开展的2b/3期临床试验(NCT03764735)显示,SkQ1能有效改善干眼症受试者的眼部症状及体征。
关于MitotechS.A.
MitotechS.A.是一家总部位于卢森堡的临床阶段生物技术公司,主要开发治疗老龄化相关性疾病创新药物。Mitotech的产品核心技术基于一类新型小分子——靶向线粒体心磷脂过氧化的抑制剂。公司先导化合物SkQ1目前正处于一系列药物剂型的开发中,覆盖多个疾病治疗领域,其中以眼科和神经退行性疾病为主。
相关新闻






























































 粤公网安备 44049102496184号
粤公网安备 44049102496184号