公司新聞
2018年7月16日,香港
億勝生物科技有限公司(“億勝生物”或“集團”;股份代號:1061)欣然公布,億勝生物投資(集團之全資附屬公司)與Mitotech 及俄羅斯Mitotech 訂立共同開發協議。據此,億勝生物投資同意資助該個用于乾眼症治療的首創新藥于美國藥監局(FDA)進行三期臨床第一階段試驗之臨床開發,從而獲取按照億勝生物投資與Mitotech 之間商議協定就該産品在全球指定區域內收取之若干收入作爲回報。
全球共同開發協議
根據協議規定,億勝生物投資同意就該産品(即以SkQ1作爲其唯一活性藥物成分之滴眼液,用于乾眼症領域治療)于FDA進行三期臨床第一階段試驗之臨床開發出資約17,000,000美元(相當于約133,450,000港元)。
另外,億勝生物投資有權就該産品之進一步開發(即三期臨床第二階段試驗)出資最多約20,000,000美元(相當于約157,000,000港元)。
許可協議
基于以上共同開發協議,珠海億勝生物製藥有限公司(集團之間接全資附屬有限公司)即將另行與Mitotech訂立許可協議。據此,珠海億勝生物製藥有限公司將就該産品(即以SkQ1作爲其唯一活性藥物成分之滴眼液)針對乾眼症及葡萄膜炎兩個領域的治療,在新加坡及大中華區域(包括中國大陸、臺灣、香港及澳門地區),獲授予獨家且永久商業化許可。
億勝董事會相信,共同開發協議及許可協議將爲訂約各方借助彼此之研發優勢及資源,以推進該個含SkQ1之滴眼液産品獲得FDA及CFDA(中國食品藥品監督總局)商業化許可,以及全球其他區域的商業化許可建立良好契機。
此次與Mitotech達成戰略合作,是億勝生物加强其在中國眼科領域地位,及開啓全球化擴張之路的戰略體現。
關于Mitotech S.A.
Mitotech S.A.是一家總部位于盧森堡的臨床階段生物技術公司,主要開發治療老齡化相關性疾病創新藥物。 Mitotech産品核心技術是基于一類新型小分子——綫粒體靶向心磷脂過氧化抑制劑。公司核心化合物SkQ1(活性藥物成分)被用于開發系列藥物劑型,目前已覆蓋以眼科和神經退行性疾病爲主的多種疾病治療領域。 Mitotech現已在美國成功完成乾眼症二期臨床研究,同時其他適應症也將逐漸進入臨床階段。
關于乾眼症
乾眼症,另稱乾燥性角膜結膜炎,是一種影響眼表泪腺功能單元的多因素慢性及潜在衰竭性疾病。乾眼症可能導致泪膜成分改變(泪膜不穩定),以致泪膜無法支持眼上皮細胞正常運作,對眼表(眼角膜)造成潜在損傷,進而引發眼表炎症。因此,乾眼症會阻礙日常活動,幷對生活質量産生負面影響。流行病學數據(表1)表明,由于對屏幕技術的依賴增加、人口老齡化以及各年齡段生活方式的變化導致乾眼症高患病率,乾眼症逐漸成爲全球範圍內的流行性疾病。
尤其是中國,地理差异性大,發病率很高。據統計,中國約有7500萬人患有乾眼症③。
當前,乾眼症患者階段性治療方法僅限于人工泪液和消炎,加之其體征和症狀未有統一的診斷標準,對于能更好支持眼科醫生實踐的有效療法獲得越來越多的關注與需求。全球乾眼症市場規模2016年約爲50.4億美元,預計到2025年底將增長至77.8億美元。雖然全球都具有高乾眼症患病率,但中國的需求尤爲明顯,2018年中國乾眼症市場規模已達約1.46億美元③④。
隨著創新藥物和合成藥物帶來的優化可行性治療方法的發展,乾眼症病理生理學機制和當前未能滿足的醫療需求將逐漸得到解决。
表一:
億勝生物科技有限公司(“億勝生物”或“集團”;股份代號:1061)欣然公布,億勝生物投資(集團之全資附屬公司)與Mitotech 及俄羅斯Mitotech 訂立共同開發協議。據此,億勝生物投資同意資助該個用于乾眼症治療的首創新藥于美國藥監局(FDA)進行三期臨床第一階段試驗之臨床開發,從而獲取按照億勝生物投資與Mitotech 之間商議協定就該産品在全球指定區域內收取之若干收入作爲回報。
全球共同開發協議
根據協議規定,億勝生物投資同意就該産品(即以SkQ1作爲其唯一活性藥物成分之滴眼液,用于乾眼症領域治療)于FDA進行三期臨床第一階段試驗之臨床開發出資約17,000,000美元(相當于約133,450,000港元)。
另外,億勝生物投資有權就該産品之進一步開發(即三期臨床第二階段試驗)出資最多約20,000,000美元(相當于約157,000,000港元)。
許可協議
基于以上共同開發協議,珠海億勝生物製藥有限公司(集團之間接全資附屬有限公司)即將另行與Mitotech訂立許可協議。據此,珠海億勝生物製藥有限公司將就該産品(即以SkQ1作爲其唯一活性藥物成分之滴眼液)針對乾眼症及葡萄膜炎兩個領域的治療,在新加坡及大中華區域(包括中國大陸、臺灣、香港及澳門地區),獲授予獨家且永久商業化許可。
億勝董事會相信,共同開發協議及許可協議將爲訂約各方借助彼此之研發優勢及資源,以推進該個含SkQ1之滴眼液産品獲得FDA及CFDA(中國食品藥品監督總局)商業化許可,以及全球其他區域的商業化許可建立良好契機。
此次與Mitotech達成戰略合作,是億勝生物加强其在中國眼科領域地位,及開啓全球化擴張之路的戰略體現。
關于Mitotech S.A.
Mitotech S.A.是一家總部位于盧森堡的臨床階段生物技術公司,主要開發治療老齡化相關性疾病創新藥物。 Mitotech産品核心技術是基于一類新型小分子——綫粒體靶向心磷脂過氧化抑制劑。公司核心化合物SkQ1(活性藥物成分)被用于開發系列藥物劑型,目前已覆蓋以眼科和神經退行性疾病爲主的多種疾病治療領域。 Mitotech現已在美國成功完成乾眼症二期臨床研究,同時其他適應症也將逐漸進入臨床階段。
關于乾眼症
乾眼症,另稱乾燥性角膜結膜炎,是一種影響眼表泪腺功能單元的多因素慢性及潜在衰竭性疾病。乾眼症可能導致泪膜成分改變(泪膜不穩定),以致泪膜無法支持眼上皮細胞正常運作,對眼表(眼角膜)造成潜在損傷,進而引發眼表炎症。因此,乾眼症會阻礙日常活動,幷對生活質量産生負面影響。流行病學數據(表1)表明,由于對屏幕技術的依賴增加、人口老齡化以及各年齡段生活方式的變化導致乾眼症高患病率,乾眼症逐漸成爲全球範圍內的流行性疾病。
尤其是中國,地理差异性大,發病率很高。據統計,中國約有7500萬人患有乾眼症③。
當前,乾眼症患者階段性治療方法僅限于人工泪液和消炎,加之其體征和症狀未有統一的診斷標準,對于能更好支持眼科醫生實踐的有效療法獲得越來越多的關注與需求。全球乾眼症市場規模2016年約爲50.4億美元,預計到2025年底將增長至77.8億美元。雖然全球都具有高乾眼症患病率,但中國的需求尤爲明顯,2018年中國乾眼症市場規模已達約1.46億美元③④。
隨著創新藥物和合成藥物帶來的優化可行性治療方法的發展,乾眼症病理生理學機制和當前未能滿足的醫療需求將逐漸得到解决。
表一:
| 國家 | 患病率①②③④⑤ |
| 美國 | 7.0% |
| 歐洲 | 14.0%—33.0% |
| 新加坡 | 12.3% |
| 中國 | 21.0%—30.0% |
| 全球 | 5.0%—34.0% |
關于SkQ1
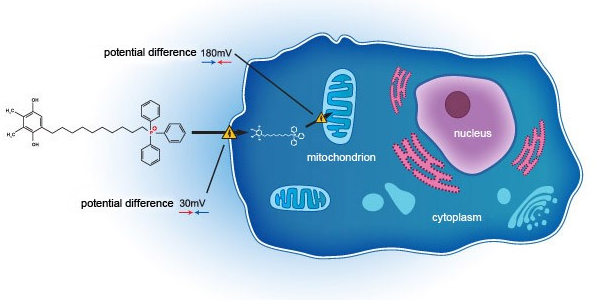
SkQ1是通過一種獨特的作用機制,通過在細胞層面上作用于綫粒體,來達到治療乾眼症的目的。實踐證明,與現行多數采用抗炎機制的治療手段不同的是,SkQ1通過靶向阻斷眼部氧化應激反應,不僅可减輕炎症反應,更是能改善眼組織退化、泪液質量下降等問題。眼部氧化應激反應普遍存在于乾眼症患病人群中, 除却病理生理學的因素,氧化應激反應其實是由于活性氧自由基(ROS)在綫粒體中過多聚集而引起的。另外,泪液高滲透壓是由乾眼症引發的眼表損傷的主要誘因,而氧化應激反應正是導致泪液高滲透壓的主要因素。
SkQ1作爲已通過美國FDA臨床二期試驗(NCT02121301)的首創新型小分子,已被證實可靶向消除綫粒體ROS以達到恢復細胞功能的目的,同時抑制泪液中TNF-α以及IL-6的生成水平,幷顯著提升IL-10的生成水平。在若干個試驗終點設計中,SkQ1相較對比組安慰劑均體現出顯著的優勢:通過减輕眼部綫粒體中氧化過激反應,以及改善乾眼症病人的體征和症狀,爲乾眼症病人帶來顯著防護效益。
Mitotech的Visomitin(含SkQ1滴眼液)針對乾眼症治療已在俄羅斯獲得商業化許可,自上市銷售至今已實現約100萬支的銷量。Mitotech首席執行官Natalia Perekhvatova表示:“臨床試驗證明,Visomitin可有效保護角膜避免損傷、改善泪液質量,同時讓病人感到舒適。我們也一直從醫生及病人群體中獲得非常積極的反饋。”
同時,億勝生物投資總裁嚴賢龍表示:“我們能與Mitotech成爲戰略合作夥伴,幷就SkQ1在美國FDA開展三期臨床試驗事宜達成全球共同開發協議感到非常興奮。通過授予我司共同開發權利,Mitotech認可億勝生物科技在大中華地區眼科領域的强勢地位,包括在研發、臨床開發、醫學推廣及市場銷售方面的優勢。我們期待著SkQ1能够進一步穩固我們在乾眼症及眼科領域的領先地位。”
相關新聞
































































 粤公网安备 44049102496184号
粤公网安备 44049102496184号