公司新聞
香港,2019年7月19日
億勝生物科技有限公司(“億勝生物”或“集團”或“公司”,股份代碼:1061)和MitotechSA(“Mitotech”)今日公布用于治療乾眼症的創新藥物SkQ1滴眼液(NCT03764735)于美國食品藥品監督管理局(FDA)三期臨床第一階段試驗(VISTA-1)的頂綫結果。
雖然未達到主要聯合臨床終點(中央角膜熒光素染色和砂礫感),但是VISTA-1臨床數據顯示出SkQ1滴眼液在一系列臨床相關症狀和體征中的見效時間令人鼓舞。相對于安慰劑,在意向治療(ITT)人群中,SkQ1滴眼液在治療4周後眼部不適症狀顯著减輕(p<0.05),在4種症狀量表中的其它症狀也有顯著减輕(p<0.05)。結膜熒光素染色在意向治療人群也顯示出相對于安慰劑的顯著降低(p<0.05)。同時,數據突出表現了藥物優秀的安全性,其耐受性在統計學意義上與人工泪液相似。
億勝生物科技首席科學家薛琦博士表示:“VISTA-1的積極結果不僅爲通過監管審批提供了有價值的指導,還體現了SkQ1在乾眼症市場中明顯的差异化定位。”
Mitotech首席執行官Natalia Perekhvatova表示:“數據本身就已經說明了一切,VISTA-1結果顯示出SkQ1快速改善一系列幹眼臨床相關症狀和體征(如眼部不適和熒光素染色),以及可與人工泪液媲美的藥物耐受性,SkQ1已成爲全球乾眼症患者重要的潜在治療方案。”
Perekhvatova女士表示:“在看到具有積極信號的臨床數據後,我們就開始準備後續VISTA-2臨床研究。在乾眼症領域開發新作用機制藥物極具挑戰性,但VISTA-1結果顯示了SkQ1在統計意義上可顯著改善乾眼症一系列症狀和體征,我們對此感到十分興奮。另外考慮到乾眼症目前的治療手段,SkQ1優异的藥物耐受性對兩家公司而言都是一筆巨大的財富。”
公司對VISTA-1中顯示出的有效性和安全性數據備受鼓舞,幷將繼續進行進一步的數據分析。基于三期臨床第一階段試驗的積極數據,億勝生物科技與Mitotech正在考慮將美國三期臨床試驗推進至下一階段,即三期臨床第二階段試驗。

關于VISTA-1
VISTA-1是一項多中心、雙盲、隨機安慰劑對照研究,包括在約9周的過程中進行5次隨訪。合格受試者(約450人)以1:1:1隨機分組接受高劑量SkQ1滴眼液(1.55ug/mL)、低劑量SkQ1滴眼液(0.155ug/mL)或安慰劑(SkQ1滴眼液載體)治療。該項研究主要臨床終點爲中央角膜熒光素染色和砂礫感症狀的8周變化(從基準點到第57天)。次要臨床終點指標包括在自然環境和受控的不良環境(僅第57天置于受控的不良環境)下角膜熒光素染色、麗絲胺綠染色、泪膜破裂時間、Schirmer試驗和結膜發紅情况等症狀。
關于乾眼症
乾眼症,另稱乾燥性角膜結膜炎,是一種影響眼表泪腺功能單元的多因素慢性及潜在衰竭性疾病。乾眼症可能導致泪膜成分改變(泪膜不穩定),以致泪膜無法支持眼表上皮細胞正常運作,對眼表(眼角膜)造成潜在損傷,進而引發眼表炎症。因此,乾眼症會阻礙日常活動,幷對生活質量産生負面影響。當前,乾眼症患者階段性治療方法僅限于人工泪液和消炎,加之其體征和症狀未有統一的診斷標準以及有效療法的匱乏,乾眼症仍然是一個高度缺醫少藥的臨床領域。根據Transparent Market Research的數據,全球乾眼症市場規模2016年約爲50.4億美元,預計到2025年底將增長至77.8億美元。
關于SkQ1
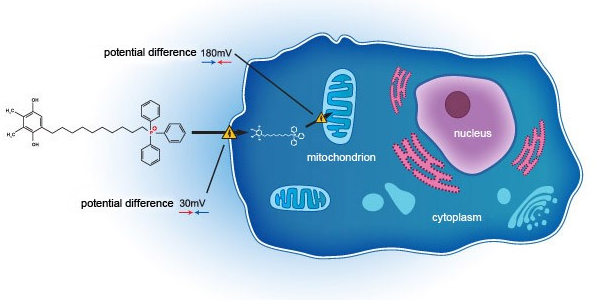
SkQ1是通過一種創新的作用機制在細胞層面上作用于綫粒體,來達到治療乾眼症的目的。實踐證明,與現行多數采用抗炎機制的治療手段不同的是,SkQ1通過靶向阻斷眼部氧化應激反應,不僅可减輕炎症反應,更是能改善眼組織退化、泪液質量下降等問題。先前在美國開展的臨床二期研究(NCT02121301)顯示,SkQ1能有效改善乾眼症受試者症狀及體征。
關于MitotechS.A.
MitotechS.A.是一家總部位于盧森堡的臨床階段生物技術公司,主要開發治療老齡化相關性疾病創新藥物。Mitotech産品核心技術是基于一類新型小分子——綫粒體靶向心磷脂過氧化抑制劑。公司核心化合物SkQ1(活性藥物成分)被用于開發一系列的藥物劑型,目前已覆蓋以眼科和神經退行性疾病爲主的多種疾病治療領域。Mitotech現已在美國順利完成乾眼症二期臨床研究,同時其他適應症也將逐漸進入臨床階段。Mitotech已在俄羅斯獲得了Visomitin(含SkQ1滴眼液)針對乾眼症治療的商業化許可。
億勝生物科技有限公司(“億勝生物”或“集團”或“公司”,股份代碼:1061)和MitotechSA(“Mitotech”)今日公布用于治療乾眼症的創新藥物SkQ1滴眼液(NCT03764735)于美國食品藥品監督管理局(FDA)三期臨床第一階段試驗(VISTA-1)的頂綫結果。
雖然未達到主要聯合臨床終點(中央角膜熒光素染色和砂礫感),但是VISTA-1臨床數據顯示出SkQ1滴眼液在一系列臨床相關症狀和體征中的見效時間令人鼓舞。相對于安慰劑,在意向治療(ITT)人群中,SkQ1滴眼液在治療4周後眼部不適症狀顯著减輕(p<0.05),在4種症狀量表中的其它症狀也有顯著减輕(p<0.05)。結膜熒光素染色在意向治療人群也顯示出相對于安慰劑的顯著降低(p<0.05)。同時,數據突出表現了藥物優秀的安全性,其耐受性在統計學意義上與人工泪液相似。
億勝生物科技首席科學家薛琦博士表示:“VISTA-1的積極結果不僅爲通過監管審批提供了有價值的指導,還體現了SkQ1在乾眼症市場中明顯的差异化定位。”
Mitotech首席執行官Natalia Perekhvatova表示:“數據本身就已經說明了一切,VISTA-1結果顯示出SkQ1快速改善一系列幹眼臨床相關症狀和體征(如眼部不適和熒光素染色),以及可與人工泪液媲美的藥物耐受性,SkQ1已成爲全球乾眼症患者重要的潜在治療方案。”
Perekhvatova女士表示:“在看到具有積極信號的臨床數據後,我們就開始準備後續VISTA-2臨床研究。在乾眼症領域開發新作用機制藥物極具挑戰性,但VISTA-1結果顯示了SkQ1在統計意義上可顯著改善乾眼症一系列症狀和體征,我們對此感到十分興奮。另外考慮到乾眼症目前的治療手段,SkQ1優异的藥物耐受性對兩家公司而言都是一筆巨大的財富。”
公司對VISTA-1中顯示出的有效性和安全性數據備受鼓舞,幷將繼續進行進一步的數據分析。基于三期臨床第一階段試驗的積極數據,億勝生物科技與Mitotech正在考慮將美國三期臨床試驗推進至下一階段,即三期臨床第二階段試驗。

關于VISTA-1
VISTA-1是一項多中心、雙盲、隨機安慰劑對照研究,包括在約9周的過程中進行5次隨訪。合格受試者(約450人)以1:1:1隨機分組接受高劑量SkQ1滴眼液(1.55ug/mL)、低劑量SkQ1滴眼液(0.155ug/mL)或安慰劑(SkQ1滴眼液載體)治療。該項研究主要臨床終點爲中央角膜熒光素染色和砂礫感症狀的8周變化(從基準點到第57天)。次要臨床終點指標包括在自然環境和受控的不良環境(僅第57天置于受控的不良環境)下角膜熒光素染色、麗絲胺綠染色、泪膜破裂時間、Schirmer試驗和結膜發紅情况等症狀。
關于乾眼症
乾眼症,另稱乾燥性角膜結膜炎,是一種影響眼表泪腺功能單元的多因素慢性及潜在衰竭性疾病。乾眼症可能導致泪膜成分改變(泪膜不穩定),以致泪膜無法支持眼表上皮細胞正常運作,對眼表(眼角膜)造成潜在損傷,進而引發眼表炎症。因此,乾眼症會阻礙日常活動,幷對生活質量産生負面影響。當前,乾眼症患者階段性治療方法僅限于人工泪液和消炎,加之其體征和症狀未有統一的診斷標準以及有效療法的匱乏,乾眼症仍然是一個高度缺醫少藥的臨床領域。根據Transparent Market Research的數據,全球乾眼症市場規模2016年約爲50.4億美元,預計到2025年底將增長至77.8億美元。
關于SkQ1
SkQ1是通過一種創新的作用機制在細胞層面上作用于綫粒體,來達到治療乾眼症的目的。實踐證明,與現行多數采用抗炎機制的治療手段不同的是,SkQ1通過靶向阻斷眼部氧化應激反應,不僅可减輕炎症反應,更是能改善眼組織退化、泪液質量下降等問題。先前在美國開展的臨床二期研究(NCT02121301)顯示,SkQ1能有效改善乾眼症受試者症狀及體征。
關于MitotechS.A.
MitotechS.A.是一家總部位于盧森堡的臨床階段生物技術公司,主要開發治療老齡化相關性疾病創新藥物。Mitotech産品核心技術是基于一類新型小分子——綫粒體靶向心磷脂過氧化抑制劑。公司核心化合物SkQ1(活性藥物成分)被用于開發一系列的藥物劑型,目前已覆蓋以眼科和神經退行性疾病爲主的多種疾病治療領域。Mitotech現已在美國順利完成乾眼症二期臨床研究,同時其他適應症也將逐漸進入臨床階段。Mitotech已在俄羅斯獲得了Visomitin(含SkQ1滴眼液)針對乾眼症治療的商業化許可。
相關新聞































































 粤公网安备 44049102496184号
粤公网安备 44049102496184号