公司新闻
香港,2019年7月19日
亿胜生物科技有限公司(“亿胜生物”或“集团”或“公司”,股份代码:1061)和MitotechSA(“Mitotech”)今日公布用于治疗干眼症的创新药物SkQ1滴眼液(NCT03764735)于美国食品药品监督管理局(FDA)三期临床第一阶段试验(VISTA-1)的顶线结果。
虽然未达到主要联合临床终点(中央角膜荧光素染色和砂砾感),但是VISTA-1临床数据显示出SkQ1滴眼液在一系列临床相关症状和体征中的见效时间令人鼓舞。相对于安慰剂,在意向治疗(ITT)人群中,SkQ1滴眼液在治疗4周后眼部不适症状显著减轻(p<0.05),在4种症状量表中的其它症状也有显著减轻(p<0.05)。结膜荧光素染色在意向治疗人群也显示出相对于安慰剂的显著降低(p<0.05)。同时,数据突出表现了药物优秀的安全性,其耐受性在统计学意义上与人工泪液相似。
亿胜生物科技首席科学家薛琦博士表示:“VISTA-1的积极结果不仅为通过监管审批提供了有价值的指导,还体现了SkQ1在干眼症市场中明显的差异化定位。”
Mitotech首席执行官Natalia Perekhvatova表示:“数据本身就已经说明了一切,VISTA-1结果显示出SkQ1快速改善一系列干眼临床相关症状和体征(如眼部不适和荧光素染色),以及可与人工泪液媲美的药物耐受性,SkQ1已成为全球干眼症患者重要的潜在治疗方案。”
Perekhvatova女士表示:“在看到具有积极信号的临床数据后,我们就开始准备后续VISTA-2临床研究。在干眼症领域开发新作用机制药物极具挑战性,但VISTA-1结果显示了SkQ1在统计意义上可显著改善干眼症一系列症状和体征,我们对此感到十分兴奋。另外考虑到干眼症目前的治疗手段,SkQ1优异的药物耐受性对两家公司而言都是一笔巨大的财富。”
公司对VISTA-1中显示出的有效性和安全性数据备受鼓舞,并将继续进行进一步的数据分析。基于三期临床第一阶段试验的积极数据,亿胜生物科技与Mitotech正在考虑将美国三期临床试验推进至下一阶段,即三期临床第二阶段试验。

关于VISTA-1
VISTA-1是一项多中心、双盲、随机安慰剂对照研究,包括在约9周的过程中进行5次随访。合格受试者(约450人)以1:1:1随机分组接受高剂量SkQ1滴眼液(1.55ug/mL)、低剂量SkQ1滴眼液(0.155ug/mL)或安慰剂(SkQ1滴眼液载体)治疗。该项研究主要临床终点为中央角膜荧光素染色和砂砾感症状的8周变化(从基准点到第57天)。次要临床终点指标包括在自然环境和受控的不良环境(仅第57天置于受控的不良环境)下角膜荧光素染色、丽丝胺绿染色、泪膜破裂时间、Schirmer试验和结膜发红情况等症状。
关于干眼症
干眼症,另称干燥性角膜结膜炎,是一种影响眼表泪腺功能单元的多因素慢性及潜在衰竭性疾病。干眼症可能导致泪膜成分改变(泪膜不稳定),以致泪膜无法支持眼表上皮细胞正常运作,对眼表(眼角膜)造成潜在损伤,进而引发眼表炎症。因此,干眼症会阻碍日常活动,并对生活质量产生负面影响。当前,干眼症患者阶段性治疗方法仅限于人工泪液和消炎,加之其体征和症状未有统一的诊断标准以及有效疗法的匮乏,干眼症仍然是一个高度缺医少药的临床领域。根据Transparent Market Research的数据,全球干眼症市场规模2016年约为50.4亿美元,预计到2025年底将增长至77.8亿美元。
关于SkQ1
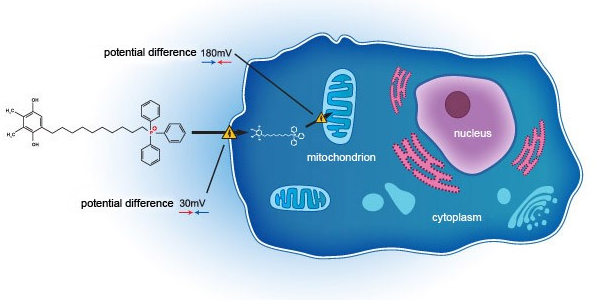
SkQ1是通过一种创新的作用机制在细胞层面上作用于线粒体,来达到治疗干眼症的目的。实践证明,与现行多数采用抗炎机制的治疗手段不同的是,SkQ1通过靶向阻断眼部氧化应激反应,不仅可减轻炎症反应,更是能改善眼组织退化、泪液质量下降等问题。先前在美国开展的临床二期研究(NCT02121301)显示,SkQ1能有效改善干眼症受试者症状及体征。
关于MitotechS.A.
MitotechS.A.是一家总部位于卢森堡的临床阶段生物技术公司,主要开发治疗老龄化相关性疾病创新药物。Mitotech产品核心技术是基于一类新型小分子——线粒体靶向心磷脂过氧化抑制剂。公司核心化合物SkQ1(活性药物成分)被用于开发一系列的药物剂型,目前已覆盖以眼科和神经退行性疾病为主的多种疾病治疗领域。Mitotech现已在美国顺利完成干眼症二期临床研究,同时其他适应症也将逐渐进入临床阶段。Mitotech已在俄罗斯获得了Visomitin(含SkQ1滴眼液)针对干眼症治疗的商业化许可。
亿胜生物科技有限公司(“亿胜生物”或“集团”或“公司”,股份代码:1061)和MitotechSA(“Mitotech”)今日公布用于治疗干眼症的创新药物SkQ1滴眼液(NCT03764735)于美国食品药品监督管理局(FDA)三期临床第一阶段试验(VISTA-1)的顶线结果。
虽然未达到主要联合临床终点(中央角膜荧光素染色和砂砾感),但是VISTA-1临床数据显示出SkQ1滴眼液在一系列临床相关症状和体征中的见效时间令人鼓舞。相对于安慰剂,在意向治疗(ITT)人群中,SkQ1滴眼液在治疗4周后眼部不适症状显著减轻(p<0.05),在4种症状量表中的其它症状也有显著减轻(p<0.05)。结膜荧光素染色在意向治疗人群也显示出相对于安慰剂的显著降低(p<0.05)。同时,数据突出表现了药物优秀的安全性,其耐受性在统计学意义上与人工泪液相似。
亿胜生物科技首席科学家薛琦博士表示:“VISTA-1的积极结果不仅为通过监管审批提供了有价值的指导,还体现了SkQ1在干眼症市场中明显的差异化定位。”
Mitotech首席执行官Natalia Perekhvatova表示:“数据本身就已经说明了一切,VISTA-1结果显示出SkQ1快速改善一系列干眼临床相关症状和体征(如眼部不适和荧光素染色),以及可与人工泪液媲美的药物耐受性,SkQ1已成为全球干眼症患者重要的潜在治疗方案。”
Perekhvatova女士表示:“在看到具有积极信号的临床数据后,我们就开始准备后续VISTA-2临床研究。在干眼症领域开发新作用机制药物极具挑战性,但VISTA-1结果显示了SkQ1在统计意义上可显著改善干眼症一系列症状和体征,我们对此感到十分兴奋。另外考虑到干眼症目前的治疗手段,SkQ1优异的药物耐受性对两家公司而言都是一笔巨大的财富。”
公司对VISTA-1中显示出的有效性和安全性数据备受鼓舞,并将继续进行进一步的数据分析。基于三期临床第一阶段试验的积极数据,亿胜生物科技与Mitotech正在考虑将美国三期临床试验推进至下一阶段,即三期临床第二阶段试验。

关于VISTA-1
VISTA-1是一项多中心、双盲、随机安慰剂对照研究,包括在约9周的过程中进行5次随访。合格受试者(约450人)以1:1:1随机分组接受高剂量SkQ1滴眼液(1.55ug/mL)、低剂量SkQ1滴眼液(0.155ug/mL)或安慰剂(SkQ1滴眼液载体)治疗。该项研究主要临床终点为中央角膜荧光素染色和砂砾感症状的8周变化(从基准点到第57天)。次要临床终点指标包括在自然环境和受控的不良环境(仅第57天置于受控的不良环境)下角膜荧光素染色、丽丝胺绿染色、泪膜破裂时间、Schirmer试验和结膜发红情况等症状。
关于干眼症
干眼症,另称干燥性角膜结膜炎,是一种影响眼表泪腺功能单元的多因素慢性及潜在衰竭性疾病。干眼症可能导致泪膜成分改变(泪膜不稳定),以致泪膜无法支持眼表上皮细胞正常运作,对眼表(眼角膜)造成潜在损伤,进而引发眼表炎症。因此,干眼症会阻碍日常活动,并对生活质量产生负面影响。当前,干眼症患者阶段性治疗方法仅限于人工泪液和消炎,加之其体征和症状未有统一的诊断标准以及有效疗法的匮乏,干眼症仍然是一个高度缺医少药的临床领域。根据Transparent Market Research的数据,全球干眼症市场规模2016年约为50.4亿美元,预计到2025年底将增长至77.8亿美元。
关于SkQ1
SkQ1是通过一种创新的作用机制在细胞层面上作用于线粒体,来达到治疗干眼症的目的。实践证明,与现行多数采用抗炎机制的治疗手段不同的是,SkQ1通过靶向阻断眼部氧化应激反应,不仅可减轻炎症反应,更是能改善眼组织退化、泪液质量下降等问题。先前在美国开展的临床二期研究(NCT02121301)显示,SkQ1能有效改善干眼症受试者症状及体征。
关于MitotechS.A.
MitotechS.A.是一家总部位于卢森堡的临床阶段生物技术公司,主要开发治疗老龄化相关性疾病创新药物。Mitotech产品核心技术是基于一类新型小分子——线粒体靶向心磷脂过氧化抑制剂。公司核心化合物SkQ1(活性药物成分)被用于开发一系列的药物剂型,目前已覆盖以眼科和神经退行性疾病为主的多种疾病治疗领域。Mitotech现已在美国顺利完成干眼症二期临床研究,同时其他适应症也将逐渐进入临床阶段。Mitotech已在俄罗斯获得了Visomitin(含SkQ1滴眼液)针对干眼症治疗的商业化许可。
相关新闻































































 粤公网安备 44049102496184号
粤公网安备 44049102496184号