Tackling solid tumour therapy with small-format drug conjugates.
2020.12.24
下載查看
華人抗體協會旗下期刊、牛津大學出版社出版的Antibody Therapeutics發表一篇原文標題為「Tackling solid tumour therapy with small-format drug conjugates」的綜述論文[1]。該文的通訊作者是帝國理工學院的Mahendra P. Deonarain。Mahendra P. Deonarain同時兼任Antikor Biopharma的CEO。文章的另外一位作者是億勝生物科技(Essex Bio-Technology)的首席科學官薛琦博士。作者以藥物偶聯物的葯代動力學和藥效學為切入點,深入分析藥物偶聯物的分子量、結構與功能之間的關係,綜合目前已知的臨床前結果和臨床試驗數據,指出小型藥物偶聯物具有穿透力強、有效荷載多等優勢。
論文摘要和亮點
近年來,隨着抗體藥物偶聯物的發展,已經有9個靶向CD33,CD30,Her2,CD22,CD79B,Nectin-4,Trop-2,CD269的抗體藥物偶聯物被批准用於腫瘤的臨床治療。但臨床前和臨床試驗數據表明,實體瘤仍然是抗體藥物偶聯物的一大挑戰,而能否穿透進入腫瘤內部直接決定了抗體藥物偶聯物的臨床療效。與傳統的抗體藥物偶聯物相比,更小的抗體片段藥物偶聯物能夠穿過屏障,更有效地將靶分子載入實體腫瘤內,同時因其能被快速清除,賦予了更寬的治療窗口(圖1)。目前,針對小型藥物偶聯物的研究集中在最適分子量的確定、提高有效的毒性荷載、增加安全範圍內的半衰期等方面。本文從靶點、偶聯物結構、葯代動力學、藥效學等方面對不斷出現的2KDa-80KDa小型藥物偶聯物進行了綜述,並指出了該領域未來的研究策略和方向。
論文摘要和亮點
近年來,隨着抗體藥物偶聯物的發展,已經有9個靶向CD33,CD30,Her2,CD22,CD79B,Nectin-4,Trop-2,CD269的抗體藥物偶聯物被批准用於腫瘤的臨床治療。但臨床前和臨床試驗數據表明,實體瘤仍然是抗體藥物偶聯物的一大挑戰,而能否穿透進入腫瘤內部直接決定了抗體藥物偶聯物的臨床療效。與傳統的抗體藥物偶聯物相比,更小的抗體片段藥物偶聯物能夠穿過屏障,更有效地將靶分子載入實體腫瘤內,同時因其能被快速清除,賦予了更寬的治療窗口(圖1)。目前,針對小型藥物偶聯物的研究集中在最適分子量的確定、提高有效的毒性荷載、增加安全範圍內的半衰期等方面。本文從靶點、偶聯物結構、葯代動力學、藥效學等方面對不斷出現的2KDa-80KDa小型藥物偶聯物進行了綜述,並指出了該領域未來的研究策略和方向。
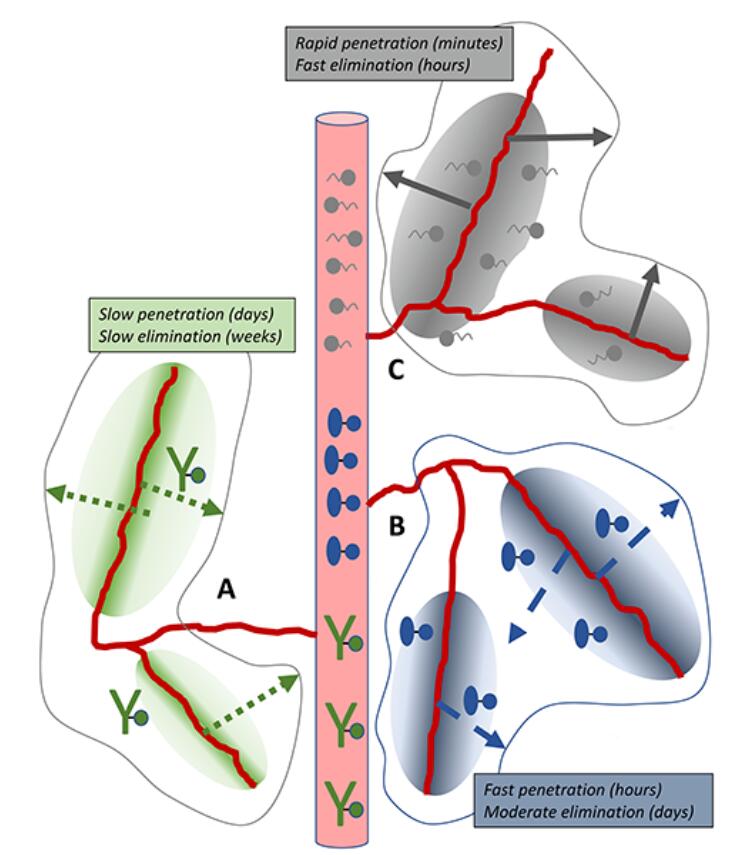
圖1 不同分子量大小的藥物偶聯物經腫瘤血管的遞送
抗體藥物偶聯物的理論基礎可以追溯到Paul Ehrlich提出的概念-「魔法子彈」,將藥物裝載到特異性的載體上靶向並殺傷腫瘤細胞 [2]。1983年,ADC首次進入臨床試驗。直到2000年,Pfizer研發的ADC藥物Mylotarg被批准用於治療白血病。但由於出現嚴重肝損傷等副作用,Mylotarg被Pfizer主動撤市,這也使得ADC藥物的研發前景飽受質疑。近二十年以來,經過偶聯技術,小分子藥物和抗體技術的創新發展,ADC藥物研發取得了重大進展。2019年FDA批准了3款ADC藥物上市,目前已經取得了數十億美元的市場份額。
在傳統ADC藥物不斷取得重大進步的背景下,新型ADC藥物的研發也開始嶄露頭角。Bolt Biotherapeutics、Sutro Biopharma、Rakuten等創新ADC研發公司運用創新技術,不斷推出新型的ADC產品。比如,Bolt Biotherapeutics推出的靶向樹突狀細胞的BDC-1001;Sutro Biopharma利用位點特異性偶聯,推出均一的蛋白質藥物偶聯物STRO-001和STRO-002;Rakuten將光敏染料與抗體偶聯,推出光敏免疫法ASP-1929。
從目前已知的臨床一期試驗數據得知,相當一部分的ADC藥物在臨床試驗中因為低療效或者高毒性而失敗。而分子量更小的抗體片段藥物偶聯物能夠克服傳統抗體藥物偶聯物的局限性。研究結果表明,針對難治性腫瘤,抗體片段藥物偶聯更容易突破腫瘤防線,滲透進入實體瘤內部發揮更好的治療效果,同時因其半衰期短,毒副作用也能夠得到更好的控制,大大提高該類藥物的安全性和有效性。本文中,薛琦博士和Mahendra P. Deonarain博士基於自己的一線研究經歷,針對性地綜述了小型ADC類藥物取得的進展(圖2)。
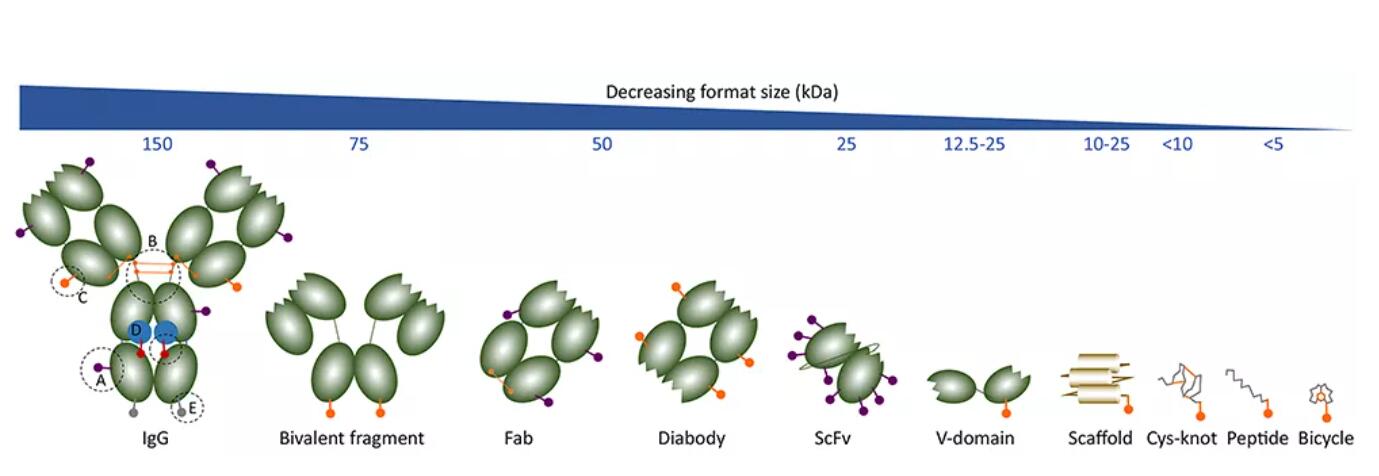
圖2 不同藥物偶聯物的大小和結構對比
通常,藥物偶聯物穿過腫瘤血管進入腫瘤組織內部可以分為以下三種葯代動力學途徑:1、傳統的抗體藥物偶聯物,分子量通常大於150KDa,需數天才能穿透腫瘤組織並蓄積,經過數周才能被清除。給葯頻率低但有高風險的脫靶-蓄積毒副作用。2、分子量5-100KDa的以蛋白為基礎的小型藥物偶聯物,包括單鏈的Fv和DARPins等,能在數小時內穿透組織並被胞吞,在數天內被清除,能夠減少非特異組織暴露時間,但仍需要新策略提高DAR、半衰期等。3、超小型肽類藥物偶聯物,分子量小於5KDa,能快速穿透並被細胞快速攝取,通常在數小時內被清除,不足之處是仍需提高靶組織瞬時暴露的給葯濃度。
該論文不僅列舉了1)基於重組抗體片段的藥物偶聯物2)非抗體藥物偶聯物和3)多肽藥物偶聯物等藥物偶聯物的優劣,而且指出了該領域未來的研究策略和方向。
參考文獻
1. Mahendra P Deonarain, Quinn Xue. Tackling solid tumour therapy with small-format drug conjugates. Antibody Therapeutics, 2020; 3: 237–245.
2. Kyoji Tsuchikama, Zhiqiang An. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018; 9: 33-46.


 粤公网安备 44049102496184号
粤公网安备 44049102496184号