Tackling solid tumour therapy with small-format drug conjugates.
2020.12.24
下载查看
华人抗体协会旗下期刊、牛津大学出版社出版的Antibody Therapeutics发表一篇原文标题为“Tackling solid tumour therapy with small-format drug conjugates”的综述论文[1]。该文的通讯作者是帝国理工学院的Mahendra P. Deonarain。Mahendra P. Deonarain同时兼任Antikor Biopharma的CEO。文章的另外一位作者是亿胜生物科技(Essex Bio-Technology)的首席科学官薛琦博士。作者以药物偶联物的药代动力学和药效学为切入点,深入分析药物偶联物的分子量、结构与功能之间的关系,综合目前已知的临床前结果和临床试验数据,指出小型药物偶联物具有穿透力强、有效荷载多等优势。
论文摘要和亮点
近年来,随着抗体药物偶联物的发展,已经有9个靶向CD33,CD30,Her2,CD22,CD79B,Nectin-4,Trop-2,CD269的抗体药物偶联物被批准用于肿瘤的临床治疗。但临床前和临床试验数据表明,实体瘤仍然是抗体药物偶联物的一大挑战,而能否穿透进入肿瘤内部直接决定了抗体药物偶联物的临床疗效。与传统的抗体药物偶联物相比,更小的抗体片段药物偶联物能够穿过屏障,更有效地将靶分子载入实体肿瘤内,同时因其能被快速清除,赋予了更宽的治疗窗口(图1)。目前,针对小型药物偶联物的研究集中在最适分子量的确定、提高有效的毒性荷载、增加安全范围内的半衰期等方面。本文从靶点、偶联物结构、药代动力学、药效学等方面对不断出现的2KDa-80KDa小型药物偶联物进行了综述,并指出了该领域未来的研究策略和方向。
论文摘要和亮点
近年来,随着抗体药物偶联物的发展,已经有9个靶向CD33,CD30,Her2,CD22,CD79B,Nectin-4,Trop-2,CD269的抗体药物偶联物被批准用于肿瘤的临床治疗。但临床前和临床试验数据表明,实体瘤仍然是抗体药物偶联物的一大挑战,而能否穿透进入肿瘤内部直接决定了抗体药物偶联物的临床疗效。与传统的抗体药物偶联物相比,更小的抗体片段药物偶联物能够穿过屏障,更有效地将靶分子载入实体肿瘤内,同时因其能被快速清除,赋予了更宽的治疗窗口(图1)。目前,针对小型药物偶联物的研究集中在最适分子量的确定、提高有效的毒性荷载、增加安全范围内的半衰期等方面。本文从靶点、偶联物结构、药代动力学、药效学等方面对不断出现的2KDa-80KDa小型药物偶联物进行了综述,并指出了该领域未来的研究策略和方向。
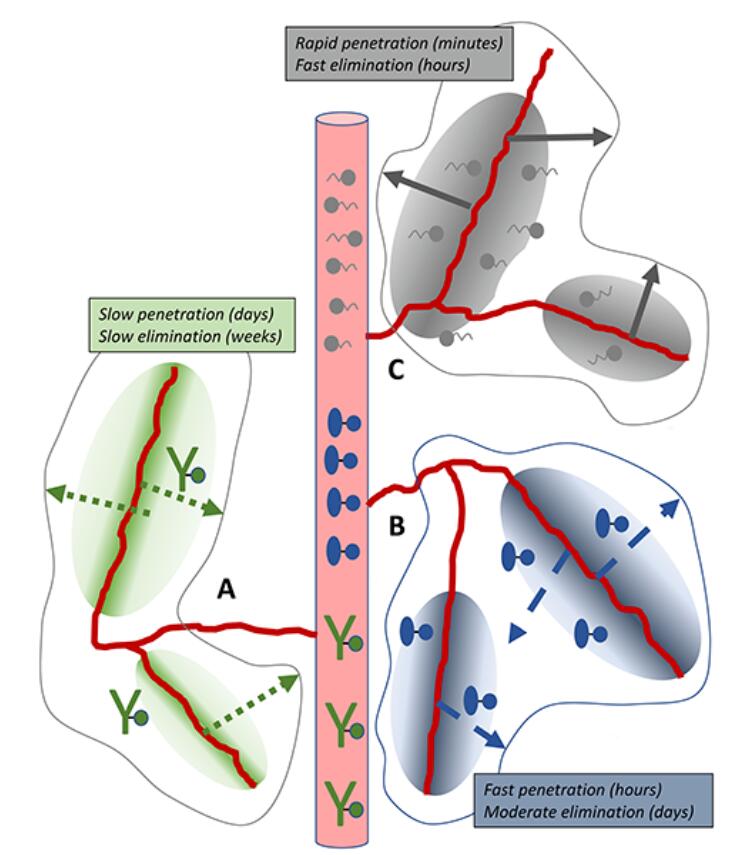
图1 不同分子量大小的药物偶联物经肿瘤血管的递送
抗体药物偶联物的理论基础可以追溯到Paul Ehrlich提出的概念-“魔法子弹”,将药物装载到特异性的载体上靶向并杀伤肿瘤细胞 [2]。1983年,ADC首次进入临床试验。直到2000年,Pfizer研发的ADC药物Mylotarg被批准用于治疗白血病。但由于出现严重肝损伤等副作用,Mylotarg被Pfizer主动撤市,这也使得ADC药物的研发前景饱受质疑。近二十年以来,经过偶联技术,小分子药物和抗体技术的创新发展,ADC药物研发取得了重大进展。2019年FDA批准了3款ADC药物上市,目前已经取得了数十亿美元的市场份额。
在传统ADC药物不断取得重大进步的背景下,新型ADC药物的研发也开始崭露头角。Bolt Biotherapeutics、Sutro Biopharma、Rakuten等创新ADC研发公司运用创新技术,不断推出新型的ADC产品。比如,Bolt Biotherapeutics推出的靶向树突状细胞的BDC-1001;Sutro Biopharma利用位点特异性偶联,推出均一的蛋白质药物偶联物STRO-001和STRO-002;Rakuten将光敏染料与抗体偶联,推出光敏免疫法ASP-1929。
从目前已知的临床一期试验数据得知,相当一部分的ADC药物在临床试验中因为低疗效或者高毒性而失败。而分子量更小的抗体片段药物偶联物能够克服传统抗体药物偶联物的局限性。研究结果表明,针对难治性肿瘤,抗体片段药物偶联更容易突破肿瘤防线,渗透进入实体瘤内部发挥更好的治疗效果,同时因其半衰期短,毒副作用也能够得到更好的控制,大大提高该类药物的安全性和有效性。本文中,薛琦博士和Mahendra P. Deonarain博士基于自己的一线研究经历,针对性地综述了小型ADC类药物取得的进展(图2)。
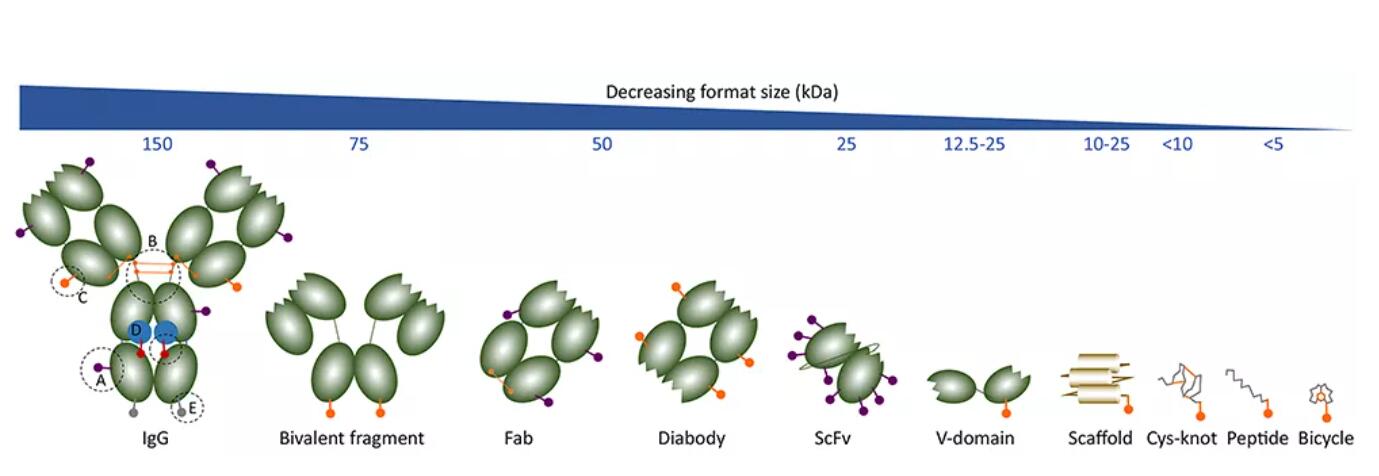
图2 不同药物偶联物的大小和结构对比
通常,药物偶联物穿过肿瘤血管进入肿瘤组织内部可以分为以下三种药代动力学途径:1、传统的抗体药物偶联物,分子量通常大于150KDa,需数天才能穿透肿瘤组织并蓄积,经过数周才能被清除。给药频率低但有高风险的脱靶-蓄积毒副作用。2、分子量5-100KDa的以蛋白为基础的小型药物偶联物,包括单链的Fv和DARPins等,能在数小时内穿透组织并被胞吞,在数天内被清除,能够减少非特异组织暴露时间,但仍需要新策略提高DAR、半衰期等。3、超小型肽类药物偶联物,分子量小于5KDa,能快速穿透并被细胞快速摄取,通常在数小时内被清除,不足之处是仍需提高靶组织瞬时暴露的给药浓度。
该论文不仅列举了1)基于重组抗体片段的药物偶联物2)非抗体药物偶联物和3)多肽药物偶联物等药物偶联物的优劣,而且指出了该领域未来的研究策略和方向。
参考文献
1. Mahendra P Deonarain, Quinn Xue. Tackling solid tumour therapy with small-format drug conjugates. Antibody Therapeutics, 2020; 3: 237–245.
2. Kyoji Tsuchikama, Zhiqiang An. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018; 9: 33-46.


 粤公网安备 44049102496184号
粤公网安备 44049102496184号